痛み学NOTE <第42回>責任TrPは腹筋にできる32015.01.08
カイロジャーナル81号 (2014.10.1発行)より
トリガーポイントはどのようにして作られるのか③
TrPの電気活動と責任TrPができる仕組み
筋収縮のプロセスの中で、エネルギー危機に関わるのは前号で説明した第1~3のステップにおいてである。
トラベルは、ATPが不足(エネルギー危機)によって、過剰な筋収縮活動が持続すると考えた。その基盤となる作用に関わるのがCaイオンとATPである。筋の外傷、微損傷、オーバーユースでも、筋小胞体からCaイオンは過剰に放出される。
筋の外傷が起こると周辺に痛覚物質が放出されるのだが、ここで問題とするのはCaイオンが過剰に放出されることによって起こる「拘縮:constracure」という現象である。拘縮では、活動電位なしで生じる持続性、非伝播性の可逆的収縮が起こる。
要するに、「拘縮」は「筋収縮」と違って、中枢神経系の介入による制御を受けない現象だということだろう。
ATPがなくなると、アクチンとミオシンは硬く結合した状態になり、引っ張っても伸びない状態が作られるのである。またATP不足は、アクチン周辺に放出されたCaイオンが筋小胞体へ取り込まれるのを阻む。だから収縮が続く。拘縮ができる。
この拘縮によって、血流が悪くなる(虚血)。痛みが出る。さらにエネルギー危機が増大する。血流の障害はATP産生が減少するため永続化する。痛みの悪循環のはじまりである。
この「筋拘縮」の発展的病理こそが「索状硬結」のこととされてきたようだ。確かに、トリガーポイント(TrP)の特徴を単直に言えば「硬結」のことだろう。「索状」でもある。しかも、電気生理学的に電気活動が計測されないのだそうで、電気的興奮による筋収縮とは違うことになる。だから「筋拘縮」と「索状硬結」は同類の表現である。
トリガーポイント仮説には、こうした曖昧な要素が随所にある。だからメディカルの領域でも定着されにくいのだろう。臨床的所見が注目されているが、組織学的・生理学的研究はこれからなのだろうと思う。
ところが近年、トリガーポイントから電気活動を記録した研究が出てきた。日本では、川喜田健司先生らの率いる明治鍼灸大学・生理学教室における研究はその筆頭である。その電気活動の波形が、運動点(運動終板)で計測される波形に類似しているのだそうだ。だからと言って、TrPが運動点だけに出来るわけではない。ここも曖昧である。
そもそも「運動終板説」が出たのは1993年で、D. R. HubbardとG. M. Berkoffの仮説とされる。筋紡錘に分布する交感神経の刺激で活動電位が発生し、反射性にシナプス内にアセチルコリンが過剰に放出される。すると筋の持続収縮が起こるのだとする仮説であるが、では圧痛のある硬結はどう説明するのだろう。
硬結部位からの電気活動は計測されても、周辺の筋組織からは計測されていない。したがって筋紡錘での活動電位と考えたわけだが、「エネルギー危機説」と「運動終板説」の両者の欠点を補う形で、「統合仮説」が流通しているようだ。
「統合仮説」はトラベルの共同研究者であるシモンズらの主張である。実験的研究による根拠は、①トリガーポイントから計測される電気活動が終板電位に似ていること、②アセチルコリンを過剰分泌状態にすると索状硬結ができること、③運動終板では痛覚閾値が低い、ということのようだ。
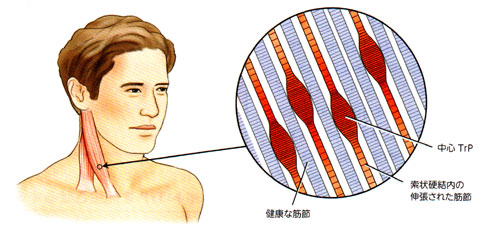
図1は『筋骨格系の触診マニュアル』のものである。この筋線維の拘縮は硬結のある索状になる。これがセントラルTrPで、その部位のサルコメアは短縮している。つまり中心に引っ張られている。するとその前後のサルコメアは中心への引力を拡散できずに伸張される。伸張性の収縮が起こる。
この索状硬結によって、筋原線維の起始と停止にまで伸張する力が及ぶ。この牽引力によって腱組織が障害され「付属TrP」が形成される。また同じ筋内や他の筋肉にサテライトTrPも形成される。これらの付属TrPは、セントラルTrPから随伴したものである。だから、鍵を握る「責任TrP」とされるのだろう。
図1 TrPの索状硬結
ゲートコントロール仮説の鎮痛機序と疑問
痛みがあると無意識にそこを擦ったり、手を添えたりする。すると不思議なことに痛みがやわらぐ。そんな経験は、誰もが少なからず持っていることだろう。この現象は多くの人の知るところであったが、その機序はよく分からないできた。
そのメカニズムを解説したのが、心理学者のメルザックと生理学者のウォールである。この理論は、1965年に「ゲートコントロール説」として「サイエンス」誌に発表されている。
原理は脊髄後角にある膠様質(後角第2層)のSG細胞と、中枢へ情報を投射するT細胞との関わりと作用に集約されている。要するに、中枢に痛み情報を伝達するT細胞(投射ニューロン)を、そのシナプス前(SG細胞)で抑制するというのである。
痛み情報は、細い神経線維(Aδ線維:1~5μm、C線維:1μm未満)が担っている。ところが、太い神経線維(Aβ線維:12~20μm)が触刺激によって興奮すると、SG細胞を興奮させてゲートを閉めてしまう(シナプス前抑制)。したがって投射ニューロンであるT細胞のシナプス前(SG細胞)で、痛覚線維からの情報は抑制されてしまう。結果的に、T細胞には痛覚情報が伝わらない、という機序になっている。この理論は、痛みの生理学における組織学的研究が幕を開けた1960年代の仮説である。多くの人が納得し、魅了させられた理論とされている。
ところが組織学的解明が進むにつれ、抑制細胞であるSG細胞なるものが、実は仮定の産物であったことが判明する。これはゲートコントロール仮説の理論的破綻でもあった。
それでも触刺激で痛みがやわらぐという現象は確かに存在するわけで、ゲートコントロール説はまたぞろ修正が加えられて徒手療法を裏付ける仮説として尊重されている。
この仮説も今では、SG細胞は抑制の「介在ニューロン」と変更され、投射ニューロン(T細胞)を直接抑制するという機序が想定されることになった。
それでも疑問が残る。なぜ、太い神経線維(Aβ線維)が入力されると痛覚線維は抑制されるか、ということである。そこにどんな法則性があるのだろう。
疼痛抑制システムの賦活には中枢系の関与なしでは考えられないことであり、ゲート理論はまだまだ研究や考察を積み重ねることが必要なようである。
